Os mini pulmões e outros organóides ajudando a vencer COVID
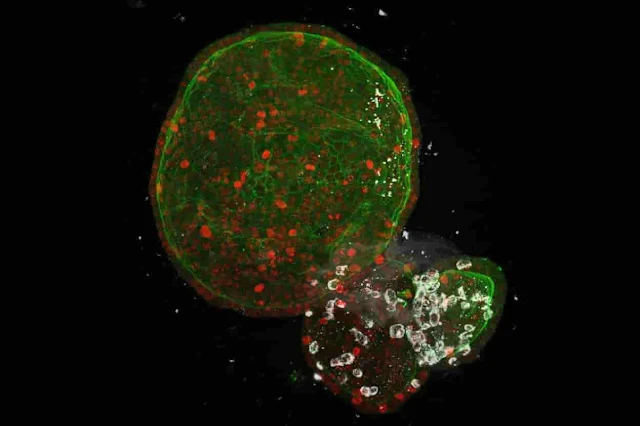 |
| Organóides do intestino humano infectados com SARS-CoV-2 (branco), o vírus que causa o COVID-19. Crédito: Joep Beumer / Hubrecht Institute |
Os virologistas infectaram milhões de órgãos em miniatura com SARS-CoV-2, para aprender como o vírus causa estragos e como evitá-los.
Smriti Mallapaty
Shuibing Chen passou quase dois meses cuidando de seus mini pulmões - cerca de meio milhão deles. Cada um parecia uma pequena nuvem de tempestade, abrigado em um prato quente e protegido por uma cúpula gelatinosa. Chen, uma bióloga de células-tronco da Weill Cornell Medicine na cidade de Nova York, e sua equipe os cultivaram a partir de aglomerados de células humanas, adicionando nutrientes a cada poucos dias à medida que cresciam em sacos de ar 3D.
Esses organóides pulmonares amadureceram até atingirem o tamanho de uma lentilha. Em seguida, a equipe os embalou e transportou, a poucos quarteirões de distância, para um laboratório autorizado a trabalhar com o SARS-CoV-2, vírus responsável pela pandemia do COVID-19. Lá, os organóides foram afogados em vírus e cada um foi contaminado com uma das 15.000 drogas. Quase todos os mini pulmões morreram, mas alguns dos medicamentos estancaram a infecção - o que representa um punhado de tratamentos possíveis para COVID-19.
Chen é um dos muitos biólogos celulares que foram impulsionados pela pandemia a ultrapassar os limites da tecnologia organoide para estudar doenças infecciosas. No ano passado, os pesquisadores criaram mini pulmões, vísceras, fígados, cérebros e muito mais para estudar como o SARS-CoV-2 infecta órgãos. Eles aprenderam quais células o vírus tem como alvo, a velocidade do ataque e como as células retaliam.
“Os organóides encontraram seu caminho para a caixa de ferramentas dos virologistas”, diz Hans Clevers, um biólogo do desenvolvimento do Instituto Hubrecht em Utrecht, Holanda. A tecnologia havia sido usada anteriormente principalmente para estudar biologia humana básica, desenvolvimento e doenças relacionadas e câncer, com apenas alguns laboratórios usando os modelos para estudar vírus e outras doenças infecciosas. Mas a pandemia trouxe os organóides ao centro do palco, estimulando artigos de alto impacto e demonstrando seu valor para o desenvolvimento de medicamentos, diz Clevers.
Mini-órgãos revelam como o coronavírus destrói o corpo
Eles são um acréscimo bem-vindo, porque os métodos atuais de estudo de vírus têm várias limitações. O burro de carga típico da virologia é uma linhagem de células cancerosas do rim de um macaco verde africano ( Chlorocebus sabaeus ), extraída pela primeira vez há quase 60 anos e dividindo-se desde então. Essas células, conhecidas como células Vero, são excelentes para o cultivo de vírus, mas não refletem a resposta antiviral normal do corpo humano. Eles estão “realmente ferrados”, diz Elke Mühlberger, virologista da Universidade de Boston em Massachusetts. Os pesquisadores também usam algumas linhagens de células humanas cancerígenas, mas, semelhantes às células Vero, elas não respondem às infecções da maneira que as células normais o fariam.
Embora os pesquisadores já tenham estabelecido a relevância potencial dos organoides para o estudo de novos medicamentos antivirais, seu trabalho ainda não levou a tratamentos comercializáveis. “A tecnologia organoide se beneficiou mais com a pandemia do que o tratamento do COVID-19 ainda se beneficiou com os organóides”, diz Clevers.
Para realizar todo o potencial da tecnologia, os cientistas ainda precisam encontrar maneiras de desenvolver sistemas mais complexos, por exemplo, adicionando células do sistema imunológico e vasos sanguíneos. Os pesquisadores também precisam agilizar o processo de produção para criar milhares, senão milhões, de organóides uniformes, de forma rápida e barata.
“O uso de organoides para estudar vírus está apenas na infância”, diz Jie Zhou, virologista da Universidade de Hong Kong.
Vírus não cultiváveis
Antes de começar a trabalhar com organoides, a virologista Mary Estes contava com uma maneira muito mais complicada de estudar o vírus do vômito, altamente contagioso, o norovírus. Ninguém conseguiu cultivar o vírus em laboratório. Então, em vez disso, ela iria isolá-lo dos excrementos de pessoas que o ingeriram voluntariamente - e sofreram as consequências - por causa de sua pesquisa.
Em 2011, ela viu um artigo de Clevers no qual ele cultivava mini-intestinos a partir de células-tronco raspadas das vilosidades, os pequenos tentáculos que revestem o intestino das pessoas 1 . Clevers criou os primeiros organóides derivados de células-tronco adultas, que crescem quase indefinidamente sob as condições certas e podem se transformar em estruturas complexas que refletem seu órgão de origem. (Os organoides já tinham sido feitos de células-tronco embrionárias ou células-tronco pluripotentes induzidas (iPS), que podem se desenvolver em qualquer tipo de célula, mas normalmente refletem órgãos no início do desenvolvimento fetal.)
“Eu pensei - bem, isso parece um sistema que devemos experimentar”, diz Estes, que está no Baylor College of Medicine em Houston, Texas. “Ninguém mais estava usando essas culturas para virologia na época”.
Em 2016 - quase meio século após sua identificação - Estes se tornou a primeira pessoa a cultivar norovírus humano em uma placa de forma que pudesse ser reproduzida, em um organoide intestinal .
Seus estudos provaram que os organóides eram um bom modelo de doença nas pessoas. Ela descobriu, por exemplo, que as variantes do norovírus não se replicam em organoides feitos de células de pessoas que normalmente não ficam doentes com o vírus .
Os pesquisadores usaram organóides para estudar muitos outros vírus, incluindo o vírus sincicial respiratório (RSV) - uma causa comum de infecção pulmonar em crianças - em organóides das vias aéreas, e o raro e misterioso vírus BK em organóides renais.
Em 2016, uma equipe infectou organoides cerebrais em desenvolvimento com o vírus Zika e estabeleceu uma ligação entre a infecção em mulheres grávidas e a microcefalia 3 , uma condição em que o feto tem uma cabeça atipicamente pequena. Dez dias após a infecção, os organóides cerebrais eram 40% menores do que os organóides não infectados. Essas células progenitoras neurais são “solo fértil para a infecção pelo zika”, diz Patricia Garcez, neurobiologista da Universidade Federal do Rio de Janeiro, Brasil, que liderou o trabalho.
Os cérebros desenvolvidos em laboratório podem se tornar conscientes ?
E em 2018, Zhou, Clevers e seus colegas desenvolveram um organoide pulmonar que poderia ser usado para avaliar rapidamente a infecciosidade de um vírus emergente da gripe 4 . As cepas conhecidas por serem altamente infecciosas em pessoas, incluindo aquela que causou a pandemia de influenza H1N1 de 2009, se replicaram muito mais rápido nos organóides do que as cepas que normalmente infectam porcos e pássaros.
Além desses exemplos, poucos virologistas haviam feito experiências com organoides quando o SARS-CoV-2 surgiu e chamou sua atenção.
Não demorou muito para que Clevers reconhecesse o potencial de seus modelos organoides para estudar um vírus desconhecido no meio de uma pandemia. Houve indícios claros da clínica de que o vírus pode afetar o intestino, especialmente em crianças, diz Clevers. Ele se perguntou se poderia usar seus organóides intestinais para ver se o vírus poderia infectar o tecido intestinal.
Em 15 de março de 2020 - o dia em que a Holanda entrou em bloqueio - ele solicitou amostras de SARS-CoV-2 de colegas em Rotterdam. Em sete semanas, ele e seus colegas publicaram um artigo na Science mostrando que o SARS-CoV-2 se replicou prontamente em mini-intestinos, visando especificamente células chamadas enterócitos que revestem os intestinos 5 . O estudo ajudou a explicar por que algumas pessoas com COVID-19 têm problemas digestivos, incluindo diarreia e vômitos, e identificou outra possível rota de transmissão.
Desde então, os pesquisadores mostraram que o SARS-CoV-2 pode infectar uma série de miniorgãos, do fígado aos rins e ao cérebro - imitando o dano a múltiplos órgãos visto em algumas pessoas com COVID-19.
Os pesquisadores usaram organóides para explorar como o SARS-CoV-2 infecta as células e para procurar tratamentos. Aqui, o vírus (branco) é mostrado infectando um organoide do intestino, o que poderia explicar por que algumas pessoas têm sintomas gastrointestinais com COVID-19.
O órgão que tem recebido mais atenção - por um bom motivo - é o pulmão. Enterrados profundamente nos pulmões estão pequenos sacos de ar chamados alvéolos - o local da pneumonia em pessoas com COVID-19 grave. Essas células são difíceis de acessar e estudar. Catherine Blish, uma imunologista viral da Universidade de Stanford, na Califórnia, e seus colegas se voltaram para as células que formam espontaneamente esses sacos de ar para investigar a infecção.
Os pesquisadores descobriram que o vírus se espalhava por organoides feitos de alvéolos e de células nas minúsculas vias aéreas que os alimentam 6 . Nos alvéolos, o SARS-CoV-2 tem como alvo as células que cobrem a superfície exposta ao ar, que são ricas no receptor ACE2, através do qual o SARS-CoV-2 ganha entrada. O vírus também afetou células nas vias aéreas que secretam uma molécula para lidar com o constante estiramento dos pulmões, chamadas células-clube. “Sem os organóides, não sei se teríamos descoberto que as células club poderiam suportar a replicação do SARS-CoV-2 porque ninguém teria pensado em colocá-lo nas células club”, diz Blish.
Outros estudos em minialvéolos revelaram detalhes da batalha que ocorre entre o vírus e as células 7 . O jovem Seok Ju, cientista do genoma do Instituto Avançado de Ciência e Tecnologia da Coreia em Daejeon, descobriu que leva cerca de um dia para as células retaliarem. Segue-se uma luta entre as células e o vírus e, a partir do terceiro dia, mais de um quarto das células começam a morrer.
Os cientistas também querem saber mais sobre como o vírus entra nas células. Em um estudo, os pesquisadores usaram a técnica de edição de genes CRISPR em organoides intestinais para identificar duas outras proteínas - TMPRSS2 e TMPRSS4 - que, juntamente com a ACE2, facilitam a entrada do vírus 8 . Outros laboratórios estão eliminando completamente o ACE2, para ver se o vírus ainda pode entrar. “Quanto mais estudamos os organóides, mais percebemos que diferentes tipos de células usam mecanismos diferentes para suportar a entrada viral”, diz Chen.
Organoides também foram usados para estudar variantes emergentes de SARS-CoV-2. Em uma pré-impressão, Clevers e seus colegas estudaram as vias aéreas humanas, os organoides alveolares e intestinais e descobriram que a variante B.1.1.7, identificada pela primeira vez no Reino Unido, poderia produzir grandes quantidades de vírus infecciosos em estágios posteriores da infecção do que os que circulavam anteriormente variantes 9 , o que pode explicar porque B.1.1.7 é mais transmissível.
Amígdalas minúsculas
Uma visão da primeira fila do vírus se espalhando pelo corpo pode ajudar os pesquisadores a identificar maneiras de detê-lo. Os organóides ajudam a preencher a lacuna entre observar o vírus em linhas celulares, que não têm a complexidade do tecido real, e em modelos animais, que refletem mal a infecção humana e são caros, diz Arinjay Banerjee, pesquisador de coronavírus da Universidade de Saskatchewan, no Canadá , que planeja usar organoides intestinais em seu trabalho.
Muitos candidatos a medicamentos que parecem promissores em camadas de células tendem a falhar em estágios posteriores, diz Blish. Um exemplo notável é a hidroxicloroquina, que foi uma das primeiras drogas anunciadas como um tratamento para COVID-19. Estudos em células Vero sugeriram que a cloroquina poderia bloquear o vírus, mas testes clínicos posteriores mostraram que ela não tinha efeito protetor. Clevers e outros observaram como o SARS-CoV-2 infecta organóides intestinais e descobriram que a rota usada para acessá-los era diferente da rota usada para infectar células Vero. Eles descobriram que a hidroxicloroquina pode bloquear o caminho do vírus nas células Vero, mas não nos organoides 10 . “Se essas triagens de drogas originais tivessem sido feitas em organoides em vez de em células Vero, a cloroquina nunca teria surgido como uma candidata promissora”, diz Clevers.
Muitos grupos de pesquisa estão tentando realizar o potencial dos organoides para a descoberta de medicamentos. Chen testou cerca de 1.000 medicamentos em minicolons e minipulmões e identificou sete que parecem promissores 11 , incluindo o antiviral remdesivir, que já havia demonstrado algum benefício para os participantes de testes clínicos. Chen vê seus resultados como provando a utilidade da triagem organoide.
A triagem de 15.000 drogas em organóides pulmonares foi sua maior tentativa até agora. Ela passou semanas aprimorando seus métodos para criar organoides tão semelhantes quanto possível. “Sempre nos preocupamos com a variação entre os organoides e comparando maçãs com laranjas”, diz Chen. A triagem é parte de um projeto maior em que vários laboratórios estão usando métodos diferentes para estudar os mesmos compostos e comparando seus resultados, diz ela.
Organoides também têm sido usados para testar vacinas. Em janeiro, os pesquisadores desenvolveram mini-amígdalas a partir de fragmentos de tecido descartado retirados durante a cirurgia. As amígdalas desempenham um papel fundamental na defesa do corpo; eles costumam ser o primeiro órgão a produzir células imunológicas contra um patógeno para garantir uma proteção duradoura.
Quando os pesquisadores adicionaram uma vacina candidata COVID-19, alguns dos organoides da tonsila produziram uma reação imunológica, gerando células T assassinas, bem como anticorpos que poderiam ter como alvo a proteína spike na superfície do vírus 12 . Mas muito trabalho precisa ser feito para entender se o que transparece em um prato reflete o que acontecerá no corpo.
Além disso, os órgãos do corpo não existem isoladamente. Para realmente entender o que acontece quando uma pessoa é infectada com SARS-CoV-2 e se as terapias funcionam, os pesquisadores precisam de sistemas mais complexos que incluam células imunológicas e células dos vasos sanguíneos.
Em um trabalho não publicado, Takanori Takebe, um cientista clínico e biólogo de células-tronco da Tokyo Medical and Dental University, cultivou células dos vasos sanguíneos em organóides do fígado e descobriu que vasos capilares e veias menores são mais suscetíveis à infecção por SARS-CoV-2 do que maiores embarcações. E Chen desenvolveu células imunológicas chamadas macrófagos em camadas de células do músculo cardíaco 13 , e está fazendo o mesmo com seus organóides pulmonares. Esses experimentos, junto com estudos em modelos animais, podem ajudar a resolver um debate contínuo sobre o que torna o COVID-19 tão mortal - o próprio vírus ou uma resposta imune hiperativa.
Idealmente, os pesquisadores desejam ser capazes de conectar os organóides. Esses sistemas podem revelar, por exemplo, como uma infecção que começa no pulmão influencia o coração ou o intestino. “O sonho de todo virologista seria ter órgãos diferentes conectados uns aos outros”, diz Mühlberger. “Quanto mais perto pudermos chegar do órgão humano, melhor será e mais aprenderemos sobre por que os vírus são tão patogênicos”.
Em 2019, Takebe conectou fígado, ducto biliar e organoides do pâncreas 14 , mas até agora, nenhuma equipe publicou artigos usando modelos de múltiplos órgãos para estudar SARS-CoV-2.
Próxima pandemia
As relações formadas entre biólogos celulares e virologistas provavelmente se estenderão além do COVID-19.
Para cada organoide que Mühlberger infectou com SARS-CoV-2, ela realizou experimentos paralelos com o vírus Ebola, a causa de uma febre hemorrágica mortal para a qual existem poucos modelos de infecção. Ela descobriu que o vírus Ebola pode infectar quase todos os tecidos, até mesmo atingindo regiões nas quais o SARS-CoV-2 não pode se aventurar. Essa capacidade pode ser o que torna o ebola tão mortal, diz ela.
Quanto à previsão da próxima pandemia, alguns pesquisadores estão se voltando para os organoides feitos de células animais.
No início de 2020, Zhou entrou em contato com Shi Zheng-Li, um virologista do Instituto de Virologia de Wuhan, na China, que ajudou a identificar o parente mais próximo conhecido do SARS-CoV-2 - o coronavírus de morcego RATG13. Shi disse que sequenciou centenas de coronavírus de morcegos, mas só conseguiu cultivar um punhado deles. Zhou se perguntou se ela poderia ajudar cultivando organóides a partir de tecido de morcego. Eles podem ser usados para testar drogas que podem atingir uma ampla gama de vírus com potencial para infectar pessoas.
Zhou cortou fragmentos de intestino de morcegos-ferradura selvagens ( Rhinolophus sinicus ) e criou intestinos de morcegos em miniatura feitos de vários tipos de células. O SARS-CoV-2 cresceu bem no intestino 15 - a primeira evidência experimental de que o coronavírus poderia infectar morcegos-ferradura, acrescentando peso à hipótese de sua origem em morcegos.
Estudar vírus com organóides ainda é uma busca nova, mas muitos os consideram um modelo estimulante para explorar as interações entre células humanas e vírus, e a tecnologia pode tornar a resposta à próxima pandemia muito mais rápida, diz Ju.
“Essas são culturas mágicas”, diz Estes. “É apenas a sua imaginação que limita onde este campo pode chegar.”






.jpg)






%20identificada%20em%20paciente%20dos%20EUA.jpg)


.png)









%20identificada%20em%20paciente%20dos%20EUA.jpg)






_11zon.webp)








-min.jpg)










.webp)
%20identificada%20em%20paciente%20dos%20EUA.jpg)
.png)







.webp)

